Untuk soal no 1
Untuk soal no 2
Kimia Organik
Kamis, 05 Desember 2019
Jumat, 22 November 2019
Kekuatan Asam dan Basa dalam Kimia Organik
Halo.. Pada blog kali ini akan dibahas mengenai Kekuatan Asam dan Basa dalam Kimia Organik. Sebagaimana kita ketahui bahwa dalam Kimia Organik pasti didalamnya terdapat banyak reaksi. Salah satu nya yaitu reaksi antara Asam dengan Basa. Asam dengan Basa itu sangat berbeda, maka dari itu sebelum saya membahas mengenai kekuatan dari masing-masing komponen tersebut mari kita simak dulu penjelasan awal mengenai asam dan basa itu sendiri.
Jika kita mendengar "asam basa" pasti yang terfikir oleh kita adalah 3 ilmuan yaitu Arrhenius, Bronsted Lowry dan Lewis.
1. Arrhenius
Teori yang pertama kali muncul mengenai asam basa ini adalah Teori asam basa menurut Arrhenius, Arrhenius ini didalam teorinya ia menjelaskan bahwa ia beranggapan bahwa reaksi asam basa hanya bisa terjadi didalam air. Sehingga ia mengatakan bahwa asam adalah H+ dan basa adalah OH-
2. Bronsted Lowry
Teori selanjutnya adalah teori asam basa menurut Bronsted Lowry. Teori ini lebih memperluas lagi mengenai asam basa, bahwa reaksi asam basa tidak hanya bisa terjadi dialam air saja. Teori asam basa menurut Bronsted Lowry mengatakan bahwa asam adalah setiap molekul atau ion yang menyumbangkan proton ke molekul atau ion lain. dan basa adalah molekul atau ion yang menerima proton itu. Sehingga asam adalah donor proton, dan basa adalah akseptor proton.
dibawah ini contoh dari definisi asam basa menurut Bronsted Lowry
Dalam reaksi tersebut HCl adalah asam karena ia menyumbangkan proton, dan NaOH itu basa karena akseptor proton. Untuk lebih jelasnya simak gambar dibawah ini
Ketika ada suatu asam dan basa yang bereaksi reaktan dan produk berada dalam suatu keadaan yang setimbang seperti gambar diatas, ahli kimia menyebutkan asam dan basa disisi kanan persamaan sebagai asam dan basa konjugat, Berikut ini labelnya
Pada gambar diatas H2SO4 adalah asam dan NH3 adalah basa. kedua asam dan basa ini bereaksi untuk membentuk anion hidrogen sulfat HSO4- dan ion amonium NH4+. Ion amonium adalah asam konjugat dari amonia, sedangkan ion bisulfat adalah basa konjugat dari asam sulfat.
3. Lewis
Lewis menjelaskan ada sejumlah reaksi yang terlihat seperti reaksi asam basa tetapi tidak melibatkan transfer proton melainkan transfer elektron yang bebas. Dari pengalaman inilah ia mendefinisikan asam sebagai molekul yang membentuk ikatan kovalen dengan menerima sepesang elektron dan basa sebagai molekul yang membentuk ikatan kovalen dengan menyumbangkan sepasang elektron. Sehingga dapat disimpulkan bahwa asam lewis adalah akseptor pasangan elektron dan basa lewis adalah donor pasangan elektron.
Kebermanfaatan asam dalam Kehidupan kita
Asam amino berfungsi dalam kehidupan kita sebagai pengatur segala proses yang terjadi didalam tubuh memperbaiki jaringan tubuh, menjaga suasana asam basa didalam tubuh serta dapat pula membentuk hormon. kata asam amino yang terlintas pada pikiran sebagian orang ialah protein. Asam amino memang merupakan bagian protein dari gugus amina yang memiliki peran penting dalam pertumbuhan tubuh dan perkembangan otak manusia.
Sekitar 75% asam amino digunakan untuk
sintesis protein. Asam-asam amino dapat diperoleh dari protein yang kita
makan atau dari hasil degradasi protein di dalam tubuh kita. Protein
yang terdapat dalam makanan di cerna dalam lambung dan usus menjadi
asam-asam amino yang diabsorpsi dan di bawa oleh darah ke hati. Protein
dalam tubuh dibentuk dari asam amino. Bila ada kelebihan asam amino akan di ubah menjadi asam ketogkutarat
yang dapat masuk kedalam siklus asam sitrat. Hati adalah organ tubuh
dimana terjadi reaksi Anabolisme dan Katabolisme. Proses Metabolik dan
katabolik juga terjadi dalam jaringan di luar hati. Asam amino yang
terdapat dalam darah berasal dari tiga sumber yaitu absorpsi melalui
dinding usus, hasil penguraian protein dalam sel dan hasil sintesis asam
amino dalam sel. Hati berfungsi sebagai pengatur konsentrasi asam amino
dalam darah. Asam amino adalah asam karboksilat yang mempunyai gugus amino. Asam
amino yang terdapat sebagai komponen protein mempunyai gugus –NH2 pada
atom karbon α dari posisi gugus –COOH. Jenis-jenis asam amino, urutan
cara asam amino tersebut terangkai, serta hubungan spasial asam-asam
amino tersebut asan menentukan struktur 3 dimensi dan sifat-sifat
biologis protein sederhana. Sedangkan Protein (akar kata protos dari bahasa Yunani yang berarti
“yang paling utama”) adalah senyawa organik kompleks berbobot molekul
tinggi yang merupakan polimer dari monomer-monomer asam amino yang
dihubungkan satu sama lain dengan ikatan peptida. Molekul protein
mengandung karbon, hidrogen, oksigen, nitrogen dan kadang kala sulfur
serta fosfor. Protein berperan penting dalam struktur dan fungsi semua
sel makhluk hidup dan virus.
Setelah kita mengetahui asam dan basa itu sendiri sekarang mengenai kekuatan asam dan basa nya.
Kekuatan asam atau basa Bronsted lowry tergantung pada sejauh mana suatu asam atau basa itu terionisasi didalam air. Meskipun ada banyak pelarut selain air, akan tetapi mengenai asam dan basa ini tidak lepas dari pelarut air. Kimiawan biasanya menggunakan autonisasi air murni untuk menentukan nilai konsentrasi larutan asam dan basa. Autonisasi adalah reaksi dua molekul air satu sama lain untuk menghasilkan ion H3O+
dan OH-
Pada reaksi diatas jumlah autoionisasi sangat kecil pada suhu 25°C jumlahnya adalah 10-7M (mol/liter). Konsentrasi H3O+
dan OH- adalah sama yaitu keduanya sebesar 10-7M. ahli kimia menyebut reaksi ini "neutral solution". Pada reaksi tersebut jika kita menambahkan senyawa yang lebih asam dari air, maka konsentrasi ion H3O+akan bertambah dan larutan bersifat asam. Sedangkan jika kita menambahkan senyawa yang lebih basa dari air makan akan meningkatkan konsentrasi ion OH- dan larutan bersifat basa.
Produk konsentrasi H3O+
dan OH- dalam air sama dengan 10-14 dan konstan atau disebut dengan istilah Kw dengan persamaan seperti berikut :
Karena konsentrasi H3O+
dan OH- sama dalam larutan netral, kita dapat dengan mudah menghitung konsentrasi keduanya, karena produk dari kedua konsentrasi adalah konstan maka ketika satu konsentrasi meningkat maka konsentrasi yang lain harus menurun. Dikarenakan konsentrasi ion hidronium H3O+ pkurang dari 10-14 maka ahli kimia mengukur konsentrasi H3O+dengan skala yang dikenal dengan pH. Nilai pH inilah yang memberikan konsentrasi ion hidronium suatu larutan . Sehingga dengan mengukur pH suatu larutan adalah cara kita untuk mengukur tingkat keasaman suatu larutan.
sehingga persamaannya adalah sebagai berikut :
dan untuk reaksi asam dalam air dengan persamaan :
Perhatikan bahwa reaksi diatas adalah suatu reaksi kesetimbangan, sebagian besar reaksi asam basa adalah reaksi kesetimbangan karena reaktan nya hanya terionisasi sebagian. Asam dan basa kuat terionisasi seluruhnya dalam air sedangkan asam dan basa lemah hanya terionisasi sebagian dalam air. Untuk menentukan kekuatan relatif suatu asam atau basa kita perlu mengetahui seberapa banyak asam atau basaterionisasi, atau terdisosiasi dalam air pada kesetimbangan, Konstanta kesetimbangan Ke, yang dapat didefinisikan sebagai berikut :
Namun, dikarenakan air merupakan pelarut yang memiliki konsentrasi konstan, sehingga untuk ionisasi asam dihasilkan dari mengalikan konstanta kesetimbangan dengan konsentrasi air :
Biasanya kita mengenal Ka adalah konstanta disosiasi asam. Nilai Ka menentukan kekuatan asam. Semakin kuat asam, semakin besar jumlah disosiasi, dengan demikian semakin kuat asam semakin besar nilai Ka. Asam kuat sepenuhnya berdisosiasi dalam air dan memiliki konstanta disosiasi besar. Sebagian besar senyawa organik adalah asam lemah dan memiliki konstanta kisaran 10-2sampai 10-60 karena asam memiliki kisaran nilai yang begitu besar untuk konstanta disosiasi, maka nilai Ka dapat dirubah ke dalam skala logaritmik mirip dengan pH. Sehingga untuk lebih jelasnya :
Asam kuat selalu bereaksi untuk membentuk basa konjugat yang lemah, dan asam lemah selalu bereaksi untuk membentuk basa konjugat yang kuat. Hal ini dikarenakan semakin kuat nya asam Bronsted Lowry, semakin melepas proton sehingga membentuk basa konjugat yang lebih stabil. Basa konjugat yang lebih stabil tidak bisa menerima proton dengan baik.
Kemudahan reaksi asam basa terjadi tergantung pada kekuatan asam dan basa. Asam dan basa kuat umumnya lebih reaktif daripada asam dan basa lemah. Namun arah reaksi dan stabilitas produk sering tergantung pada kualitas lain, yaitu kekerasan atau kelembutan asam atau basa.Asam memiliki orbital kosong dan cangkang kosong tidak terisi sedangkan basa memiliki cangkang valensi sepasang elektron tidak terikat yang bisa disumbangkan. Berikut merupakan penjelasan mengenai asam keras, asam lembut, basa keras, dan basa lembut.
- Asam lembut, untuk asam lunak atom akseptor pasangan elektron berukuran besar, memiliki kerapatan muatan positif yang rendah, dan mengandung pasangan elektron yang tidak terbagi dalam cangkang valensi mereka. asam lunak memiliki polarisasi yang tinggi dan elektronegativitas yang rendah. Dalam kimia organik asam lunak biasanya hanya mencakup senyawa halogen,fosfor, dan sulfur. Polarisasi artinya kemampuan suatu atom untuk memiliki distribusi elektron yang terdistorsi.
- Asam keras, Untuk asam keras, atom akseptor kecil, memiliki kecepatan muatan positif yang tinggi, dan tidak mengandung pasangan elektron yang tidak terbagi dalam cangkang valensi mereka. memiliki polarisasi yang rendah dan elektronegativitas yang tinggi. Ion hidrogen adalah contoh asam keras yang baik.
- Untuk basa lembut, basa lunak memiliki polarisasi yang tinggi, kepadatan muatan negatif rendah dan elektronegativitas rendah. basa lunak contohnya adalah ion sianida, dan iodida
- Basa keras, untuk basa keras, atom donor berukuran kecil, memiliki kerapatan muatan negatif yang tinggi dan memegang elektron valensi dengan kencang. Memiliki polarisasi yang rendah dan elektronegativitas yang tinggi. ion Hidroksida adalah contoh basa keras.
1. Perhatikan dua struktur senyawa berikut ini
struktur 1 adalah sikloheksanol sedangkan struktur 2 adalah fenol. Jika kita lihat kedua struktur ini hampir sama hanya saja struktur fenol dilengkapi dengan cincin aromatik (benzen), bisakah anda jelaskan alasan fenol (yang memiliki cincin aromatik) mengapa tingkat kekuatan asam nya lebih tinggi dibandingkan dengan sikloheksanol?
2. Perhatikan gambar dibawah ini
Struktur diatas bagaimana tingkat kekuatan keasaman antara asam asetat dan metil alkohol yg dipengaruhi oleh anion yg memiliki perbedaan cara penstabilan anion.
3. Kita perlu memastikan bagaimana efek kekuatan asam atau basa ketika terjadi perubahan struktur. Jika asam asetat (CH3COOH) digantikan salah satu gugus metil hidrogennya dengan atom klor, sehingga terbentuk asam kloroasetat (ClCH2CO2), Bagaimanakah perubahan kekuatan asam yang terjadi dari perubahan kedua struktur tersebut?
2. Perhatikan gambar dibawah ini
3. Kita perlu memastikan bagaimana efek kekuatan asam atau basa ketika terjadi perubahan struktur. Jika asam asetat (CH3COOH) digantikan salah satu gugus metil hidrogennya dengan atom klor, sehingga terbentuk asam kloroasetat (ClCH2CO2), Bagaimanakah perubahan kekuatan asam yang terjadi dari perubahan kedua struktur tersebut?
Minggu, 10 November 2019
Prinsip-prinsip dalam Sintesis Senyawa Organik (part 2)
Halo.. Pada blog kali ini akan dibahas mengenai sintesis senyawa organik. Setelah sebelumnya membahas mengenai prinsip-prinsip nya. Pada prinsip senyawa organik yang perlu diperhatikan adalah pengetahuan,kreativitas, sentuhan-sentuhan artistik, ketekunan, stamina,keterampilan eksperimental, keberanian dan karakter. Sesuai dengan pertemuan sebelumnya hal-hal yang perlu diperhatikan dalam mensintesis suatu senyawa organik sudah dibahas.
Untuk blog kali ini akan lebih dijelaskan mengenai sintesis senyawa yang dihasilkan dari mikroorganisme sehingga ia dapat berfungsi. Untuk lebih spesifiknya kita akan membahas mengenai Retrosynthesis analysis. Retrosintesis sangat diperlukan dalam mensintesis suatu senyawa, dimana retrosintesis ini merupakan teknik awal untuk melakukan sintesis, hal ini dikarenakan senyawa organik banyak yang memiliki molekul kompleks sehingga harus direduksi untuk menjadi suatu struktur yang lebih sederhana.
Didalam perencanaan ataupun langkah awal suatu sintesis ini terbagi menjadi 2 yaitu Linear Synthesis dan Convergent Synthesis.
1. Linear Synthesis
Bisa dilihat pada gambar diatas itu merupakan sintesis linear. Pada sintesis ini terlihat lebih panjang, untuk menghasilkan suatu senyawa F-G-I diperlukannya step hingga 5 tahap, sehingga kalau diperhatikan reaksinya monoton jadi tidak fleksibel. Untuk hasil keseluruhannya diperoleh sebesar 59%.
2. Convergent Synthesis
Gambar diatas merupakan sintesis konvergen. Pada sintesis ini lebih pendek dibandingkan dengan sintesis linear, dan juga lebih efisien. dapat dilihat pada sintesis convergen ini untuk menghasilkan suatu senyawa F-G-I (sama dengan sintesis linear) sintesis convergen ini hanya butuh 4 tahapan saja, sehingga keberhasilan untuk sintesisnya juga lebih tinggi dibandingkan dengan sintesis linear.
Istilah-istilah dalam retrosintesis
1. Diskoneksi
Diskoneksi bisa juga diartikan sebagai pemutusan atau pemisahan. Yang dipisah adalah ikatan karbon-karbon yang tujuannya untuk menghasilkan senyawa yang lebih sederhana. Biasanya pemecahan molekul ini dikombinasikan antara Fungsional Gugus Interkonversi (FGI) dengan diskoneksi.
Diskoneksi memiliki aturan yang perlu diperhatikan :
- Diskoneksi sebisa mungkin dilakukan pada bagian tengah molekul supaya menghasilkan dua molekul yang seimbang
- Diskoneksi sebaiknya pada posisi titik cabang yang lebih berantai lurus supaya menghindari adanya halangan sterik
- Diskoneksi untuk senyawa aromatik secara umum dilakukan pada gugus atau substituennya
- Urutan reaksi harus diperhatikan pada faktor efisiensi
- Jika terdapat 2 gugus senyawa aromatik yang berbeda, pemutusan ikatan berdasarkan pada reaktivitas relatifnya. Gugus deaktivasi harus diputus terlebih dahulu
2. Fungsional Grup Interkonversi (FGI)
FGI ini menggambarkan proses konversi satu kelompok fungsi ke gugus fungsi yang lain. FGI ini menjadi reaksi yang memfasilitasi suatu diskoneksi. Artinya senyawa melalui proses FGI dulu baru kemudian mengalami diskoneksi.
Dibawah ini merupakan analisis retrosintesis dari senyawa muscalure yang didalamnya terdapat diskoneksi dan FGI.
Strategi dalam Retrosintesis
Yang harus diperhatikan dalam retrosintesis adalah kepolaran ikatan dalam suatu gugus fungsi. Diskoneksi yang berdasarkan pada kepolaran akan menghasilkan dua pasang fragmen yang disebut sinton.
Sinton merupakan sebuah fragmen hasil dari diskoneksi selama analisis retrosintesis. Suatu sintesis yang setara didapatkanlah sebuah reagen yang dihasilkan dari sinton yang nantinya reagen ini dibutuhkan dalam langkah selanjutnya dalam sintesis.
Untuk lebih jelasnya, Pembahasan kali ini akan diberikan contoh mengenai senyawa kimia khusus yang berperan didalam alkaloid yaitu senyawa sesiline yang terdapat dalam mikroorganisme Acanthopanax sessiliflorus.
Gambar diatas merupakan buah Manchu Gingseng atau Acanthopanax sessiliflorus, buah ini berfungsi dalam dunia medis, yaitu sebagai obat untuk beberapa penyakit seperti diabetes dan tumor. Buah Acanthopanax sessiliflorus memiliki aktivitas antitrombotik dan antiplatelet yang berperan penting dalam obat hipertensi. didalam senyawa tersebut terdapat senyawa alkaloid yaitu "sesiline". Dibawah ini merupakan struktur sesiline yang terdapat didalam buah Acanthopanax sessiliflorus.
Langkah 1 :
Pada diskoneksi tersebut memutus ikatan eter pada senyawa sessiline
sehingga dihasilkan 2 senyawa yaitu 5-hidroksipirolidin dan
5-hidroksilmetilfuran.
Langkah 2 :
Selanjutnya 5-hidrosipirolidin dan 5-hidroksilmetilfuran ini disintesis dari suksinimida yang terjadi secara dua tahap dengan menggunakan sintesis linear, hasil nya didapatkan senyawa amidokarbinol yang didapatkan dari hasil hidrolisis dari air mendidih, dengan reaksi sebagai berikut :
Langkah 3 :
Selanjutnya yaitu sintesis 5-hidroksimetilfurfural. pada tahap ini 5-hidroksimetilfural (3) didapat dari alkohol furfuril (6). pertama itu alkohol furfuril di-asetilasi untuk menghasilkan furfuril asetat (7), sedangkan 5-hidroksimetilfurfuran didapatkan dari deasetilasi, reaksinya sebagai berikut :
Langkah 4 :
Selanjutnya yaitu 5-hidroksipirolidin dan 5-hidroksimetilfuran direaksikan dengan suhu 60 derajat celcius sehingga dihasilkan senyawa sesiline. reaksinya :
Langkah 5 :
Tidak ada katalis ataupun asam yang dibutuhkan untuk mensintesis senyawa sesiline karena dengan menaikkan temperatur sudah cukup untuk menghasilkan senyawa sesiline ini. Untuk lebih jelasnya mengenai sesiline ini berikut mekanisme reaksi untuk pembuatan sesiline
Permasalahan :
1. Seperti yang telah dijelaskan pada blog diatas retrosintesis analisis senyawa sesiline menggunakan diskoneksi pada langkah awalnya, lalu mengapa diskoneksi atau pemutusan rantai pada senyawa sesiline ini dilakukan pada ikatan eter nya? bisakah anda jelaskan mengapa ikatan eter yang menjadi target molekul (TM).
2. Dalam sintesis senyawa sesiline terdapat 2 perlakuan yang berbeda, alkohol furfuril di-asetilasi sedangkan 5 hidroksimetilfuran di deasetilasi, kita ketahui pada strukturnya sama sama ada cincin furan lalu mengapa harus dibedakan perlakuan untuk mensintesisnya?
3. Dalam sintesis senyawa sesilin diketahui gabungan dari 2 senyawa : 5-hidroksipirolidin dan 5-hidroksimetilfuran, biasakan anda jelaskan bagaimana kedua gugus yang berbeda ini (pirol dan furan) dapat berikatan sehingga bisa menjadi senyawa sesiline?
Jumat, 01 November 2019
Prinsip-prinsip dalam sintesis senyawa Organik (part 1)
Haloo.. Pada blog kali ini akan membahas mengenai kimia organik lanjutan khususnya dengan materi "Prinsip-prinsip sintesis senyawa Organik". Pada materi kali ini kita akan mengupas lebih dalam bagaimana cara membuat suatu senyawa organik sehingga ia dapat bermanfaat dalam kehidupan kita sehari-hari. Senyawa organik merupakan senyawa yang sangat berperan penting dalam kehidupan kita. Senyawa ini tidak datang begitu saja, ia mengalami beberapa proses tahapan baik itu penggabungan, ataupun pelepasan gugus sehingga ia dapat menjadi suatu senyawa yang sempurna dan memiliki nilai guna. Nah, pada kali ini akan dibahas mengenai bagaimana proses senyawa itu terbentuk.
Didalam mensisntesis senyawa orgabik terdapat beberapa hal yang harus diperhatikan, biasanya sintesis senyawa organik ini dilakukan oleh ahli kimia yang mana aspek yang perlu diperhatikan itu yaitu sebagai berikut :
1. Kerangka Karbon
Didalam mensintesis senyawa organik yang harus diperhatikan yaitu kerangka karbonnya. Dimana pada sintesis senyawa organik kita harus membangun kerangka karbon atau kerangka molekul yang diinginkan.
2. Gugus Fungsi
Selain dari senyawa karbon, yang harus diperhatikan adalah gugus fungsi yang akan kita buat. Untuk membuat gugus fungsi yang kita inginkan, kita bisa memperkenalkan, menghapus atau mentransformasikan gugus fungsi yang ada untuk mencapai fungsi senyawa yang diinginkan.
3. Memperhatikan Stereoisomer.
Stereoisomer sangat penting diperhatikan, karena untuk melakukan stereokontrol nantinya pada setiap tahap kita perlu melihat dimana pusat dan stereoisomer yang dibuat atau dipengaruhi.
Selain dari hal tersebut diatas, sebagaimana kita ketahui bahwa yang namanya sintesis adalah harus menghasilkan produk yang diinginkan dalam jumlah yang sesuai (wajar) maka dari itu, harus sesingkat dan seefesien mungkin. Artinya, urutan ataupun tahapan juga sangat perlu digaris bawahi. Urutan atau tahapan dua atau tiga langkah untuk menghasilkan produk biasanya lebih baik daripada enam atau tujuh tahap, karena semakin panjang tahapan atau langkahnya maka semakin banyak waktu yang diperlukan maka keefesiennya juga makin menurun.

Pada tabel tersebut diatas bisa kita pahami dalam mensintesis suatu senyawa kita menggunakan reaksi. Nah pada gambar tersebut diatas merupakan reaksi-reaksi yang terjadi pada sintesis senyawa organik. Selain itu di tabel diatas dijelaskan juga diskoneksi, sinton dan reaksi yang terjadi.
1. Diskoneksi
Didalam sintesis senyawa pasti kita tidak jarang menemukan suatu senyawa yang kompleks dan rumit, atau yang saling berhimpit sehingga perlu dipisahkan dulu agar menjadi suatu senyawa yang kita inginkan. Cara kita memutus senyawa ini dinamakan diskoneksi.
akan tetapi dalam diskoneksi ini terdapat banyak hal yang harus kita perhatikan yaitu sebagai berikut :
- Diskoneksi diusahakan disekitar bagian tengah molekul
- pada rantai yang lurus
- Pada gugus substituennya (senyawa aromatik)
- Faktor efisiensi
- Pemotongan ikatan berdasarkan pada reaktivitas relatifnya
dalam memutuskan suatu ikatan senyawa kita juga harus melakukan interkonversi terlebih dahulu supaya senyawa yang sudah diputus tidak rusak. Dan dapat tetap memiliki nilai guna.
3. Sinton
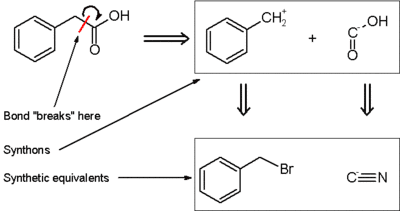
Didalam diskoneksi sinton ini sangat berguna karena sinton ini dapat menentukan reagen-reagen dalam reaksi, dimana reagen-reagen inilah yang nantinya menggantikan sinton itu sendiri. untuk lebih jelasnya lihat gambar dibawah ini
sinton untuk senyawa yang berbeda, disini saya mencontohkan :
Pada blog kali ini untuk lebih menambah pemahaman mengenai prinsip sintesis senyawa organik saya mencontohkan yaitu senyawa 1,3,5 Triazin. Senyawa ini rumus kimia nya yaitu (HCN)3 merupakan cincin aromatik anggota 6.
dalam mensintesis senyawa ini pertama, ada tahap persiapan 1,3,5 triazin simetris tersubstitusi nitril aromatik. Yang perlu dipersiapkan yaitu tris pirazolil 1,3,5 triazin dengan menggunakan katalis yaitu garam itium sehingga terdapat 2 struktur yang berbeda
1. Cincin pirazol dan triazin yang langsung melekat melalui ikatan karbon-karbon (gambar 1)
2. Cincin pirazol dan triazin yang dipisahkan oleh cincin benzen (gambar 2)
Dalam sintesis senyawa organik kondisi reaksi sangat perlu diperhatikan, misalnya suhu dan tekanan yang tinggi sehingga hambatan sterik nya semakin sensitif. pada gambar dibawah ini terdapat contoh senyawa 2c yang tersubstitusi orto didapatkan hasil yang sangat rendah dan hanya dapat dideteksi dengan spektroskopi NMR.
Selain itu, didalam sintesis senyawa organik kita bisa membandingkan antara 2 perlakuan yang dilakukan, misalnya dalam sintesis senyawa triazin ini dibandingkan penggunaan yttrium triflourosulfonat Y(TfO)3 dengan asam lewis dengan bantuan silika dan proses pemanasan yang dipengaruhi radiasi gelombang mikro 27.
Dari tabel tersebut diatas kita mengetahui bahwa :
1. Reaksi dengan iradiasi gelombang mikro memberikan hasil terbaik dalam waktu yang singkat. yaitu ketika reaksinya diperpanjang hingga 24 jam dibawah pemanasan maka hasil persentase nya itu meningkat.
2. Penggunaan asam lewis yang didukung oleh silika menghasilkan hasil yang sama. Gel silika Si(Zn) yang dimodifikasi memberikan hasil terbaik. Zn lebih lunak daripada Al dan Ti. Reaksi piperidin dan morfolin yang digunakan untuk menginduksi siklotrimerisasi dengan paraklorobenzonitril menyebabkan substitusi nukleofilik aromatik klorin, sedangkan parametoksibenzonitril diberikan para-hidroksibenzonitril sehingga yang terjadi adalah gel silika yang dimodifikasi dengan asam lewis adalah katalis yang paling efektif untuk siklotrimerisasi Nitril alifatik dan aromatik untuk menghasilkan 1,3,5 triazin.
Permasalahan :
1. Bagaimana jika katalis yang kita gunakan dalam mensintesis suatu senyawa 1,3,5-triazin kita hapuskan artinya tidak memakai katalis akan tetapi suhu yang kita gunakan pada pembuatan senyawa tersebut kita naikkan, apa yang akan terjadi?
2. Salah satu hal yang paling terpenting dalam sintesis senyawa organik adalah mengenai kerangka karbon dalam senyawa yang disintesis, menurut anda, bagaimanakah susunan kerangka karbon pada sintesis 1,3,5-triazin yang dibuat dengan katalis garam itium?
3. Mengapa dalam sintesis senyawa organik halangan sterik menjadi salah satu faktor yang perlu diperhatikan?
Rabu, 30 Oktober 2019
Minggu, 20 Oktober 2019
Karakterisasi Senyawa Bahan Alam (2)
Pada blog kali ini pembahasan yang akan dibahas yaitu mengenai senyawa bahan alam. Sebagaimana kita ketahui bahwa senyawa bahan alam merupakan senyawa organik yang memiliki fungsi dan manfaatnya dalam kehidupan kita sehari-hari. Bicara soal karakteristik pasti yang dibahas mengenai sifat dan karakter dari senyawa itu, serta yang paling penting adalah turunan dari senyawa itu sendiri. Seperti yang sudah dijelaskan pada pertemuan sebelumnya dalam mata kuliah Kimia Organik III, Karakteristik senyawa bahan alam bersifat non polar. Tersusun oleh Karbon (C) dan juga Hidrogen (H). Salah satu golongan senyawa metabolit sekunder adalah golongan alkaloid. Alkaloida merupakan golongan senyawa organik yang terbanyak ditemukan dialam. Hampir semua senyawa alkaloid yang ada berasal dari tumbuh-tumbuhan dan tersebar luas dalam berbagai jenis tumbuhan. Biasanya alkaloida ini bersifat basa dan dalam sebagian besar atom nitrogen ini merupakan bagian dari cincin heterosiklik. Tidak semua alkaloida bermanfaat, ada juga alkaloida yang beracun. Contoh alkaloida yang berguna dalam kesehatan kita adalah :
- Kuinin
- Morfin
- Stiknin
Biasanya alkaloid ini tidak mempunyai tatanama sistematik, makanya alkaloid itu dinyatakan dengan nama trivial misalnya kuinin, morfin dan stiknin. Ciri dari alkaloida dapat dilihat dari akhiran nama yang berakhiran -in.
Selanjutnya kita akan membahas karakteristik dari senyawa alkaloid. Disini saya mencontohkan yaitu alkaloid kuinin yang biasanya terdapat pada tumbuhan kina sebagai obat malaria.
Dibawah ini merupakan struktur kuinin
Kuinin merupakan senyawa alkaloid yang biasanya diperoleh dari kulit pohon sinkona. Sebagaimana kita ketahui pohon sinkona mengandung lebih dari 20 alkaloid. Akan tetapi pada pengobatan yang bermanfaat hanya 2 pasang isomer yaitu, kina dan kuinidin serta sinkona dan sinkonidin.
kuinakrin merupakan senyawa yang memiliki fungsi sebagai anti malaria. Kuinakrin merupakan contoh turunan 9-aminoakridin. Yang bekerja sebagai schizontosida eritrosik. Sifat dari kuinakrin ini yaitu tumorigenik dan mutagenik dan juga telah digunakan sebagai obat sklerosis.
2. Klorokuin
Klorokuin merupakan turunan dari 4-aminokuinolin yang mempunyai aktivitas antimalaria yang lebih tinggi dibanding kuinin. Pada karakternya klorokuin ini memiliki struktur yang mirip dengan turunan 8-aminokuinolin. Rantai samping dari klorokuin memiliki kesamaan dengan kuinakrin. Akan tetapi berbeda pada cincin kuinolin nya dan residu metoksi yang tidak dimiliki oleh kuinakrin. Gugus amin tersier pada cincin kuinolin inilah yang berperan pada aktivitasnya sebagai anti malaria. Selain itu atom klorin juga memiliki fungsi sebagai aktivitas antimalaria yang ditimbulkan.
3. Primakuin
Primakuin merupakan turunan dari 8-aminokuinolin. Pada turunan ini menimbulkan toksisitas lebih besar dibanding turunan 4-aminokuinolin atau kuinakrin. Sama seperti 2 contoh turunan diatas primakuin berfungsi sebagai obat malaria. Akan tetapi anti malaria yang satu ini tidak digunakan sebagai profilaksis. Dan juga spektrum aktivitasnya paling sempit jika dibandingkan dengan antimalaria yang sudah dijelaskan diatas.
Karakteristik dari primakuin ini adalah rantai sampingnya terdiri dari 4 atom C dan amin aromatik yang merupakan amin sekunder yang dapat memberikan aktivitas antimalaria yang optimal. Selain itu gugus 6 metoksi mempunyai aktivitas optimal meskipun batas keamanan yang rendah yang dapat saja diganti dengan atom H atau gugus hidroksi.
Permasalahan :
1. Bisakah anda jelaskan mengapa senyawa organik bahan alam ini fungsinya sebagian besar dalam bidang kesehatan
2. Seperti yang sudah dijelaskan diatas ada kuinakrin, klorokuin dan primakuin, bisakah anda jelaskan bagaimana ketiga senyawa ini bekerja sehingga dapat menjadi obat antimalaria?
3. Apa saja dampak dari senyawa bahan alam bagi tubuh kita jika penggunaannya secara berlebihan ?
Langganan:
Komentar (Atom)
-
Kembali lagi bersama saya setelah sekian lama vakum menulis di blog. Nah pada blog kali ini kita akan membahas tentang kimia organik t...
-
Pada penjelasan kali ini akan membahas mengenai reaksi Eliminasi E2. sebelum itu kita harus mengetahui apa itu reaksi Eliminasi. Reaksi Elim...
-
Seperti yang sama-sama kita ketahui, Reaksi eliminasi terbagi menjadi dua yaitu eliminasi 1 (E1) dan eliminasi 2 (E2). Pada pembahas...